Hóa học là môn khoa học thực nghiệm đòi hỏi sự kết hợp giữa lý thuyết và kỹ năng giải bài tập. Nhiều học sinh thường gặp khó khăn khi áp dụng kiến thức vào giải quyết các bài tập hóa học. Thực tế, không phải ai cũng biết cách tiếp cận và vận dụng các phương pháp giải bài tập hóa học một cách hiệu quả. Trong bài viết này, https://chars.edu.vn/ sẽ giới thiệu chi tiết các phương pháp giải bài tập hóa học từ cơ bản đến nâng cao, giúp bạn nắm vững kiến thức và cải thiện kết quả học tập.
Tổng quan về các phương pháp giải bài tập hóa học
Trước khi đi vào chi tiết từng phương pháp, chúng ta cần hiểu rõ về phân loại bài tập hóa học và tầm quan trọng của việc nắm vững các phương pháp giải bài tập.
Phân loại bài tập hóa học
Bài tập hóa học thường được phân thành các nhóm chính sau:
- Bài tập định tính: Yêu cầu xác định tính chất, hiện tượng, cấu tạo của chất
- Bài tập định lượng: Liên quan đến tính toán số lượng, nồng độ, khối lượng
- Bài tập về phản ứng hóa học: Tập trung vào viết, cân bằng và phân tích phản ứng
- Bài tập tổng hợp: Kết hợp nhiều kiến thức, phương pháp khác nhau để giải
Mỗi loại bài tập đòi hỏi phương pháp tiếp cận riêng, nhưng có những nguyên tắc chung có thể áp dụng cho hầu hết các trường hợp.
Tầm quan trọng của phương pháp giải bài tập
Nắm vững các phương pháp giải bài tập hóa học mang lại nhiều lợi ích:
- Giúp tiết kiệm thời gian làm bài
- Tăng độ chính xác, hạn chế sai sót
- Phát triển tư duy logic, khả năng phân tích
- Áp dụng kiến thức lý thuyết vào thực tế
- Cải thiện điểm số và thành tích học tập

Phương pháp giải bài tập hóa học cơ bản
1. Phương pháp đọc kỹ đề bài và phân tích thông tin
Đây là bước đầu tiên và quan trọng nhất trong quá trình giải bài tập hóa học.
Các bước thực hiện:
- Đọc kỹ đề bài ít nhất 2 lần
- Gạch chân hoặc đánh dấu các thông tin quan trọng
- Xác định yêu cầu của bài tập (tìm gì, tính gì)
- Liệt kê các dữ kiện đã cho
- Kiểm tra đơn vị đo lường, chuyển đổi nếu cần thiết
Ví dụ: Cho 100ml dung dịch NaOH 0,2M tác dụng với 200ml dung dịch HCl 0,15M. Tính pH của dung dịch sau phản ứng.
Phân tích thông tin:
- Thể tích dung dịch NaOH: V₁ = 100ml = 0,1L
- Nồng độ NaOH: C₁ = 0,2M
- Thể tích dung dịch HCl: V₂ = 200ml = 0,2L
- Nồng độ HCl: C₂ = 0,15M
- Yêu cầu: Tính pH của dung dịch sau phản ứng
2. Phương pháp lập phương trình phản ứng hóa học
Phương trình hóa học là nền tảng để giải quyết hầu hết các bài tập hóa học.
Quy trình thực hiện:
- Xác định các chất tham gia phản ứng
- Xác định loại phản ứng (phản ứng trao đổi, oxi hóa – khử, đốt cháy…)
- Viết phương trình phản ứng
- Cân bằng phương trình về nguyên tử và điện tích
- Kiểm tra lại phương trình đã cân bằng
Ví dụ: Tiếp tục bài tập trên, ta có phương trình:
NaOH + HCl → NaCl + H₂O
3. Phương pháp sử dụng định luật bảo toàn khối lượng
Các bước áp dụng:
- Xác định khối lượng/số mol các chất tham gia phản ứng
- Dựa vào hệ số trong phương trình hóa học để tính toán
- Áp dụng nguyên tắc: số mol chất tạo thành = số mol chất phản ứng × tỷ lệ hệ số
Áp dụng cho ví dụ trên:
- Số mol NaOH: n₁ = C₁ × V₁ = 0,2M × 0,1L = 0,02 mol
- Số mol HCl: n₂ = C₂ × V₂ = 0,15M × 0,2L = 0,03 mol
- Theo phương trình phản ứng, NaOH và HCl phản ứng theo tỷ lệ 1:1
- NaOH là chất hạn chế, HCl dư
- Số mol NaOH phản ứng hết: 0,02 mol
- Số mol HCl phản ứng: 0,02 mol
- Số mol HCl dư: 0,03 – 0,02 = 0,01 mol
4. Phương pháp giải bài tập nồng độ dung dịch
Đây là một trong những dạng bài tập thường gặp nhất.
Các công thức cần nhớ:
- Nồng độ mol/lít (M): C = n/V
- Nồng độ phần trăm: C% = (m₁/m₂) × 100%
- Mol chất: n = m/M (M là khối lượng mol)
Ví dụ tiếp theo: Tính pH của dung dịch sau phản ứng
- Dung dịch sau phản ứng có HCl dư
- Thể tích dung dịch sau phản ứng: V = 0,1L + 0,2L = 0,3L
- Nồng độ HCl sau phản ứng: C = 0,01mol / 0,3L = 0,033M
- pH = -log[H⁺] = -log(0,033) ≈ 1,48
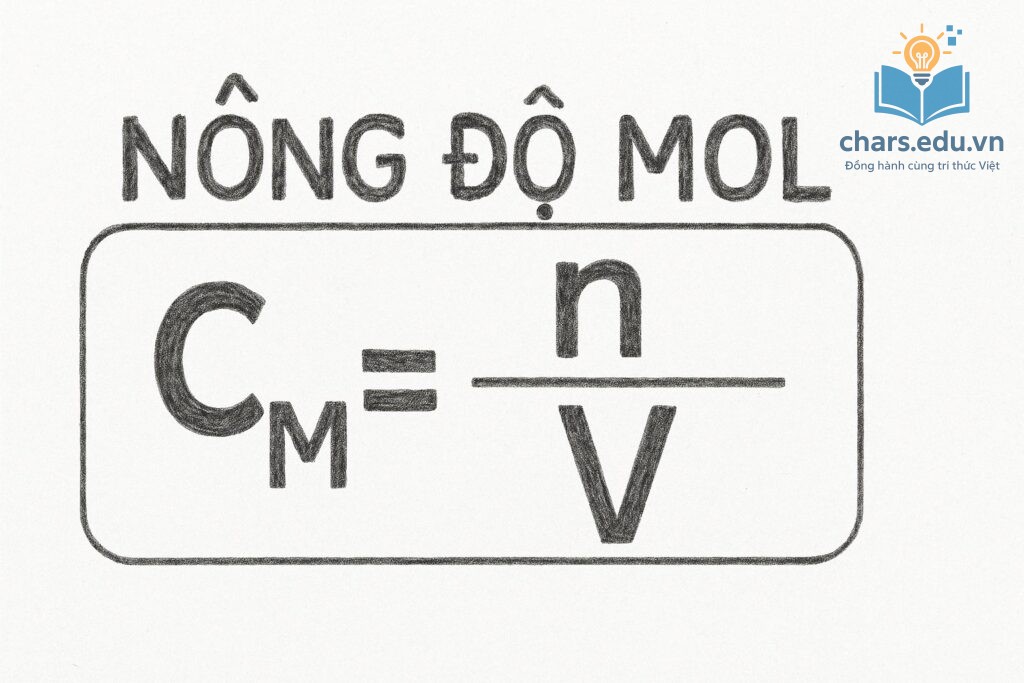
Phương pháp giải bài tập hóa học nâng cao
1. Phương pháp đại số trong giải bài tập hóa học
Phương pháp này đặc biệt hữu ích cho các bài tập phức tạp, đòi hỏi giải hệ phương trình.
Quy trình:
- Đặt ẩn số cho các đại lượng cần tìm
- Thiết lập hệ phương trình dựa trên các mối quan hệ
- Giải hệ phương trình để tìm giá trị ẩn số
Ví dụ: Hỗn hợp X gồm hai ancol đơn chức là đồng đẳng kế tiếp nhau. Đốt cháy hoàn toàn 0,1 mol X, thu được 6,16 gam CO₂. Xác định công thức phân tử của hai ancol.
Giải:
- Gọi hai ancol là CₙH₂ₙ₊₁OH và Cₙ₊₁H₂ₙ₊₃OH
- Gọi số mol của CₙH₂ₙ₊₁OH là a, số mol của Cₙ₊₁H₂ₙ₊₃OH là b
- Ta có: a + b = 0,1 (phương trình 1)
- Khi đốt cháy: CₙH₂ₙ₊₁OH + (3n/2)O₂ → nCO₂ + (n+1)H₂O
- Cₙ₊₁H₂ₙ₊₃OH + (3n+3)/2 O₂ → (n+1)CO₂ + (n+2)H₂O
- Số mol CO₂ = na + (n+1)b = 6,16/44 = 0,14 (phương trình 2)
- Từ (1) và (2), ta giải ra được n = 1, a = 0,06, b = 0,04
- Vậy hai ancol là CH₃OH và C₂H₅OH
2. Phương pháp bảo toàn electron trong phản ứng oxi hóa – khử
Các bước thực hiện:
- Xác định số oxi hóa của các nguyên tố trước và sau phản ứng
- Xác định quá trình oxi hóa và khử riêng biệt
- Cân bằng số electron nhận và cho
- Hoàn thiện phương trình phản ứng
Ví dụ: Cân bằng phương trình sau bằng phương pháp thăng bằng electron:
KMnO₄ + H₂SO₄ + FeSO₄ → Fe₂(SO₄)₃ + MnSO₄ + K₂SO₄ + H₂O
Giải:
- Xác định số oxi hóa:
- Mn trong KMnO₄: +7
- Mn trong MnSO₄: +2
- Fe trong FeSO₄: +2
- Fe trong Fe₂(SO₄)₃: +3
- Phương trình electron:
- Mn⁺⁷ + 5e⁻ → Mn⁺² (Mn bị khử)
- Fe⁺² → Fe⁺³ + 1e⁻ (Fe bị oxi hóa)
- Cân bằng electron:
- Mn⁺⁷ + 5e⁻ → Mn⁺² (×1)
- Fe⁺² → Fe⁺³ + 1e⁻ (×5)
- Phương trình hoàn chỉnh:
KMnO₄ + 8H₂SO₄ + 5FeSO₄ → 5/2 Fe₂(SO₄)₃ + MnSO₄ + 1/2 K₂SO₄ + 8H₂O
Nhân với 2 để loại phân số:
2KMnO₄ + 16H₂SO₄ + 10FeSO₄ → 5Fe₂(SO₄)₃ + 2MnSO₄ + K₂SO₄ + 16H₂O
3. Phương pháp bảo toàn nguyên tố
Phương pháp này đặc biệt hiệu quả khi giải các bài tập phức tạp về hỗn hợp chất.
Quy trình:
- Lập bảng theo dõi sự biến đổi của mỗi nguyên tố
- Viết phương trình biểu diễn sự bảo toàn của từng nguyên tố
- Thiết lập và giải hệ phương trình
Ví dụ: Cho 11,2 gam Fe vào dung dịch chứa 0,15 mol Cu(NO₃)₂. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam hỗn hợp kim loại. Tính giá trị của m.
Giải:
- Phản ứng xảy ra: Fe + Cu²⁺ → Fe²⁺ + Cu
- Số mol Fe = 11,2/56 = 0,2 mol
- Bảo toàn nguyên tố:
- Fe ban đầu: 0,2 mol
- Cu ban đầu: 0,15 mol
- Sau phản ứng:
- Fe phản ứng: 0,15 mol (do Cu²⁺ là chất hạn chế)
- Fe dư: 0,2 – 0,15 = 0,05 mol
- Cu sinh ra: 0,15 mol
- Khối lượng hỗn hợp kim loại:
m = 0,05 × 56 + 0,15 × 64 = 2,8 + 9,6 = 12,4 (gam)
4. Phương pháp giải bài tập dựa trên bảng chuyển hóa
Phương pháp này rất hiệu quả cho các bài tập về chuỗi phản ứng và chuyển hóa hóa học.
Các bước thực hiện:
- Lập bảng với các hàng là các chất, các cột là các phản ứng
- Điền thông tin về số mol hoặc khối lượng của các chất
- Sử dụng định luật bảo toàn để hoàn thiện bảng
- Từ bảng, xác định giá trị cần tìm
Ví dụ: Cho m gam hỗn hợp X gồm Fe, Fe₃O₄ và Fe₂O₃ tác dụng với dung dịch HNO₃ loãng dư, thu được 6,72 lít khí NO (đktc) và dung dịch Y chỉ chứa muối Fe(NO₃)₃. Tính m.
Giải:
Ta lập bảng chuyển hóa:
| Chất | Ban đầu | Phản ứng | Sau phản ứng |
|---|---|---|---|
| Fe | a mol | a mol | 0 |
| Fe₃O₄ | b mol | b mol | 0 |
| Fe₂O₃ | c mol | c mol | 0 |
| NO | – | (3a + 10b + 2c)/3 mol | (3a + 10b + 2c)/3 mol |
| Fe(NO₃)₃ | – | (a + 3b + 2c) mol | (a + 3b + 2c) mol |
- Số mol NO = 6,72/22,4 = 0,3 mol
- Từ đó: (3a + 10b + 2c)/3 = 0,3
- Hay: 3a + 10b + 2c = 0,9
- Khối lượng hỗn hợp X: m = 56a + 232b + 160c
Để tìm m, ta cần thêm thông tin hoặc điều kiện, ví dụ nếu biết tỉ lệ mol giữa các chất.
Kỹ thuật giải bài tập đặc thù trong hóa học
1. Phương pháp giải bài tập về dung dịch điện ly
Quy trình:
- Xác định các ion trong dung dịch
- Viết phương trình cân bằng điện ly
- Áp dụng định luật bảo toàn khối lượng và điện tích
- Sử dụng các công thức về pH, pOH
Ví dụ: Tính pH của dung dịch CH₃COOH 0,1M biết Ka = 1,8 × 10⁻⁵.
Giải:
- Cân bằng điện ly: CH₃COOH ⇌ CH₃COO⁻ + H⁺
- Gọi nồng độ H⁺ là x, ta có:
- [H⁺] = [CH₃COO⁻] = x
- [CH₃COOH] = 0,1 – x ≈ 0,1 (vì axit yếu)
- Hằng số cân bằng: Ka = [H⁺][CH₃COO⁻]/[CH₃COOH] = x²/0,1 = 1,8 × 10⁻⁵
- Từ đó: x = √(1,8 × 10⁻⁵ × 0,1) = 1,34 × 10⁻³
- pH = -log(1,34 × 10⁻³) ≈ 2,87
2. Phương pháp giải bài tập về cân bằng hóa học
Quy trình:
- Xác định phản ứng và hằng số cân bằng
- Thiết lập biểu thức hằng số cân bằng
- Xác định nồng độ ban đầu và sự thay đổi
- Giải phương trình để tìm nồng độ cân bằng
Ví dụ: Phản ứng N₂ + 3H₂ ⇌ 2NH₃ có hằng số cân bằng Kc = 4,3 ở nhiệt độ T. Ban đầu chỉ có 0,2 mol N₂ và 0,6 mol H₂ trong bình 1 lít. Tính nồng độ NH₃ khi phản ứng đạt cân bằng.
Giải:
- Lập bảng nồng độ:
| Chất | Ban đầu | Biến đổi | Cân bằng
|
|---|---|---|---|
| N₂ | 0,2 | -x | 0,2-x |
| H₂ | 0,6 | -3x | 0,6-3x |
| NH₃ | 0 | +2x | 2x |
- Hằng số cân bằng: Kc = [NH₃]²/([N₂][H₂]³) = (2x)²/((0,2-x)(0,6-3x)³) = 4,3
- Đây là phương trình bậc cao, có thể giải gần đúng hoặc dùng phương pháp thử dần
- Giả sử x = 0,05, ta có:
Kc = (0,1)²/((0,15)(0,45)³) ≈ 3,7 - Giá trị này khá gần với 4,3, có thể tinh chỉnh thêm
- Vậy [NH₃] = 2x ≈ 0,1M
3. Phương pháp giải bài tập về nhiệt động hóa học
Quy trình:
- Xác định các đại lượng nhiệt động đã biết
- Áp dụng các định luật nhiệt động (Hess, Kirchhoff)
- Tính toán các đại lượng cần tìm (ΔH, ΔG, ΔS)
Ví dụ: Tính nhiệt phản ứng chuẩn của phản ứng:
CH₄(k) + 2O₂(k) → CO₂(k) + 2H₂O(l)
biết nhiệt phản ứng chuẩn của các phản ứng:
- C(r) + O₂(k) → CO₂(k): ΔH₁° = -393,5 kJ/mol
- H₂(k) + 1/2O₂(k) → H₂O(l): ΔH₂° = -285,8 kJ/mol
- C(r) + 2H₂(k) → CH₄(k): ΔH₃° = -74,9 kJ/mol
Giải:
- Áp dụng định luật Hess:
ΔH° = ΔH₁° + 2×ΔH₂° – ΔH₃° - Thay số:
ΔH° = -393,5 + 2×(-285,8) – (-74,9)
ΔH° = -393,5 – 571,6 + 74,9 = -890,2 kJ/mol
4. Phương pháp giải bài tập về điện cực và điện hóa
Quy trình:
- Xác định các phản ứng xảy ra ở điện cực
- Áp dụng định luật Faraday
- Tính toán các đại lượng liên quan
Ví dụ: Điện phân dung dịch CuSO₄ với điện cực trơ, cường độ dòng điện 2A trong thời gian 16 phút 5 giây. Tính khối lượng Cu bám vào catot.
Giải:
- Phản ứng ở catot: Cu²⁺ + 2e⁻ → Cu
- Số mol electron: n(e) = It/(F) = 2×(16×60+5)/(96500) = 0,02 mol
- Theo phản ứng, cứ 2 mol e⁻ sinh ra 1 mol Cu
- Số mol Cu = 0,02/2 = 0,01 mol
- Khối lượng Cu = 0,01 × 64 = 0,64 gam
Chiến lược rèn luyện kỹ năng giải bài tập hóa học
1. Phương pháp học tập hiệu quả
Để nâng cao kỹ năng giải bài tập hóa học, học sinh nên:
- Nắm vững lý thuyết trước khi làm bài tập: Kiến thức nền tảng là chìa khóa để giải bài tập thành công
- Luyện tập thường xuyên: Bắt đầu từ bài tập cơ bản, tăng dần độ khó
- Phân tích lỗi sai: Sau mỗi bài tập, xác định lỗi sai và điều chỉnh
- Học nhóm: Trao đổi phương pháp giải với bạn bè
- Tổng hợp kiến thức: Tạo sơ đồ tư duy, bảng công thức để dễ nhớ
2. Kỹ thuật tránh sai lầm phổ biến
Một số lỗi thường gặp khi giải bài tập hóa học:
- Không cân bằng phương trình hóa học đúng: Kiểm tra kỹ số nguyên tử và điện tích
- Nhầm lẫn đơn vị: Chuyển đổi đơn vị ngay từ đầu
- Tính toán sai: Kiểm tra lại các phép tính
- Không xác định chất hạn chế: Luôn xác định chất nào phản ứng hết trước
- Thiếu điều kiện phản ứng: Một số phản ứng cần điều kiện đặc biệt để xảy ra
3. Cách tiếp cận bài tập mới
Khi gặp dạng bài tập chưa từng làm:
- Phân tích kỹ đề bài: Xác định thông tin đã biết và cần tìm
- Liên hệ với kiến thức đã học: Tìm kiếm mối liên hệ với các dạng bài đã biết
- Sử dụng phương pháp loại trừ: Loại bỏ các cách tiếp cận không khả thi
- Chia nhỏ vấn đề: Tách bài toán phức tạp thành các phần đơn giản
- Tham khảo tài liệu: Tìm hiểu thêm từ các nguồn đáng tin cậy
Ứng dụng các phương pháp giải bài tập trong các chủ đề hóa học
1. Các phương pháp giải bài tập hóa vô cơ
Bài tập về phi kim và hợp chất của phi kim:
- Chú ý đến tính oxi hóa-khử của phi kim
- Với hợp chất của phi kim, xem xét cấu trúc phân tử và tính chất
Bài tập về kim loại và hợp chất của kim loại:
- Với kim loại: chú ý dãy điện hóa, khả năng khử
- Với hợp chất: xem xét tính bazơ, tính oxi hóa-khử
Ví dụ: Cho 2,7 gam Al tác dụng với dung dịch H₂SO₄ loãng dư. Tính thể tích khí H₂ (đktc) thoát ra.
Giải:
- Phương trình: 2Al + 3H₂SO₄ → Al₂(SO₄)₃ + 3H₂
- Số mol Al = 2,7/27 = 0,1 mol
- Theo phương trình: n(H₂) = 3×n(Al)/2 = 3×0,1/2 = 0,15 mol
- Thể tích H₂ = 0,15 × 22,4 = 3,36 lít
2. Các phương pháp giải bài tập hóa hữu cơ
Bài tập về hiđrocacbon:
- Xem xét cấu trúc phân tử, độ bất bão hòa
- Chú ý tính chất đặc trưng: oxi hóa, cộng, thế
Bài tập về dẫn xuất của hiđrocacbon:
- Xác định nhóm chức và phản ứng đặc trưng
- Chú ý đến phản ứng tách, thế, cộng, trùng hợp
Ví dụ: Đốt cháy hoàn toàn 0,1 mol hỗn hợp hai ancol đơn chức, thu được 8,96 lít CO₂ (đktc). Xác định công thức của hai ancol.
Giải:
- Phương trình: CₙH₂ₙ₊₁OH + (3n/2)O₂ → nCO₂ + (n+1)H₂O
- Số mol CO₂ = 8,96/22,4 = 0,4 mol
- Gọi a, b là số mol hai ancol với số nguyên tử C lần lượt là n₁, n₂
Ta có:
- a + b = 0,1
- a×n₁ + b×n₂ = 0,4
- Hai ancol đơn chức nên n₁, n₂ là số nguyên
- Từ hai phương trình, ta thử các giá trị:
Nếu n₁ = 2, n₂ = 6, thì a = 0,07, b = 0,03 - Vậy hai ancol là C₂H₅OH và C₆H₁₃OH
3. Bài tập tổng hợp và ứng dụng thực tế
Các bài tập tổng hợp thường đòi hỏi kết hợp nhiều phương pháp khác nhau và có tính thực tiễn cao.
Ví dụ: Một loại phân bón NPK có hàm lượng đạm, lân, kali lần lượt là 15%, 10% và 5% (tính theo nguyên tố). Tính khối lượng phân bón cần dùng để bón cho 1 ha lúa, biết lượng đạm cần thiết là 120 kg/ha.
Giải:
- Gọi m là khối lượng phân bón cần dùng (kg)
- Lượng đạm (N) trong phân bón: 15% × m = 0,15m (kg)
- Theo đề bài: 0,15m = 120
- Vậy m = 120/0,15 = 800 kg
- Kiểm tra:
- Lượng lân (P): 10% × 800 = 80 kg
- Lượng kali (K): 5% × 800 = 40 kg
Các câu hỏi thường gặp về phương pháp giải bài tập hóa học
Làm thế nào để xác định đúng phương pháp giải cho một bài tập hóa học?
Để xác định phương pháp giải phù hợp, bạn cần phân tích kỹ đề bài và xác định loại bài tập đó thuộc về chủ đề nào (hóa vô cơ, hữu cơ, dung dịch, điện hóa…). Tiếp theo, xác định dữ liệu đã cho và yêu cầu cần tìm. Từ đó, liên hệ với các phương pháp đã học để chọn cách tiếp cận phù hợp nhất. Thông thường, mỗi dạng bài tập sẽ có các phương pháp giải quen thuộc.
Làm sao để cải thiện tốc độ giải bài tập hóa học?
Để tăng tốc độ giải bài tập, bạn cần:
- Nắm vững công thức và nguyên lý cơ bản
- Luyện tập thường xuyên các dạng bài tập
- Tạo bộ sưu tập công thức và phương pháp tính nhanh
- Học cách ước lượng kết quả để kiểm tra
- Nhận diện nhanh các dạng bài tập quen thuộc
Có những tài liệu nào tốt để học phương pháp giải bài tập hóa học?
Một số tài liệu tốt bạn có thể tham khảo:
- Sách giáo khoa và sách bài tập Hóa học
- Tài liệu luyện thi THPT Quốc gia và đại học
- Các website chuyên về hóa học như Hoc24.vn, Vietjack.com
- Kênh YouTube chuyên về hóa học của các giáo viên nổi tiếng
- Các ứng dụng học tập trên điện thoại
Làm thế nào để nhớ tất cả các công thức hóa học cần thiết?
Thay vì cố gắng nhớ máy móc, hãy:
- Hiểu rõ bản chất và nguồn gốc của công thức
- Tạo sơ đồ tư duy, bảng biểu tổng hợp
- Chia nhỏ thành các nhóm công thức theo chủ đề
- Luyện tập áp dụng liên tục
- Tạo các câu hoặc từ khóa để nhớ công thức
Làm cách nào để hạn chế sai sót khi giải bài tập hóa học?
Để giảm thiểu sai sót:
- Đọc kỹ đề bài nhiều lần
- Ghi chép cẩn thận và có tổ chức
- Kiểm tra lại các phép tính
- Ước lượng đáp số để phát hiện sai sót
- Kiểm tra các đơn vị đo lường
- Kiểm tra lại kết quả bằng cách thay vào đề bài
Câu hỏi thường gặp
Những dạng bài tập hóa học nào thường xuất hiện trong các kỳ thi?
Các dạng bài tập thường xuất hiện trong kỳ thi bao gồm: bài tập về cân bằng phương trình hóa học, bài tập tính toán theo phương trình hóa học, bài tập về tốc độ phản ứng và cân bằng hóa học, bài tập về dung dịch điện ly, bài tập về điện cực và điện hóa, bài tập về hóa hữu cơ (nhận biết đồng phân, xác định công thức phân tử), và bài tập tổng hợp.
Làm thế nào để vượt qua nỗi sợ môn hóa học?
Để vượt qua nỗi sợ môn hóa học, bạn nên:
- Bắt đầu từ những khái niệm cơ bản
- Chia nhỏ bài học thành các phần dễ tiếp thu
- Liên hệ kiến thức hóa học với thực tế đời sống
- Học nhóm với bạn bè
- Đặt câu hỏi và tìm hiểu sâu hơn về những vấn đề chưa rõ
- Tìm kiếm sự hỗ trợ từ giáo viên hoặc gia sư
Có phương pháp nào giúp ghi nhớ dãy hoạt động hóa học của kim loại không?
Để nhớ dãy hoạt động hóa học của kim loại, bạn có thể sử dụng câu ghi nhớ hoặc từ viết tắt. Ví dụ, để nhớ thứ tự K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Au, bạn có thể tạo câu “Kẻ Cả Nói Mà Anh Zui Fe(phải) Niệm Suy Phản Hối Cũng Hết Ai Giúp” (chữ cái đầu của mỗi từ tương ứng với ký hiệu nguyên tố).
Làm thế nào để phân biệt các loại phản ứng hóa học?
Để phân biệt các loại phản ứng hóa học, bạn cần chú ý đến:
- Phản ứng trao đổi: A + BC → AB + C
- Phản ứng phân hủy: AB → A + B
- Phản ứng hóa hợp: A + B → AB
- Phản ứng thay thế: A + BC → AC + B
- Phản ứng oxi hóa – khử: có sự thay đổi số oxi hóa
Mỗi loại phản ứng có đặc điểm riêng về sự thay đổi hóa trị, cấu trúc phân tử, và năng lượng.
Có những công cụ hoặc phần mềm nào hỗ trợ học hóa học hiệu quả?
Một số công cụ và phần mềm hữu ích:
- ChemDraw: vẽ công thức cấu tạo hóa học
- Periodic Table Pro: bảng tuần hoàn tương tác
- Chemistry Calculator: tính toán phản ứng hóa học
- Khan Academy: video bài giảng hóa học
- Quizlet: thẻ ghi nhớ và trắc nghiệm
- ChemCollective: phòng thí nghiệm ảo
- Socrative: làm bài tập và kiểm tra kiến thức
Các phương pháp giải bài tập hóa học là công cụ quan trọng giúp học sinh tiếp cận và giải quyết hiệu quả các bài toán hóa học từ cơ bản đến nâng cao. Thông qua việc nắm vững các phương pháp như phân tích đề bài, lập phương trình hóa học, bảo toàn khối lượng, bảo toàn electron và các phương pháp chuyên biệt cho từng dạng bài tập, học sinh có thể tự tin đối mặt với những thách thức trong học tập môn hóa.
Để thành công trong việc giải bài tập hóa học, điều quan trọng là phải kết hợp giữa việc học lý thuyết vững chắc và luyện tập thường xuyên. Hãy nhớ rằng, mỗi bài tập là một cơ hội để ứng dụng kiến thức và rèn luyện kỹ năng. Với sự kiên trì và phương pháp học tập đúng đắn, bạn sẽ ngày càng tiến bộ và đạt kết quả cao trong môn hóa học.
